728x90
반응형
목차
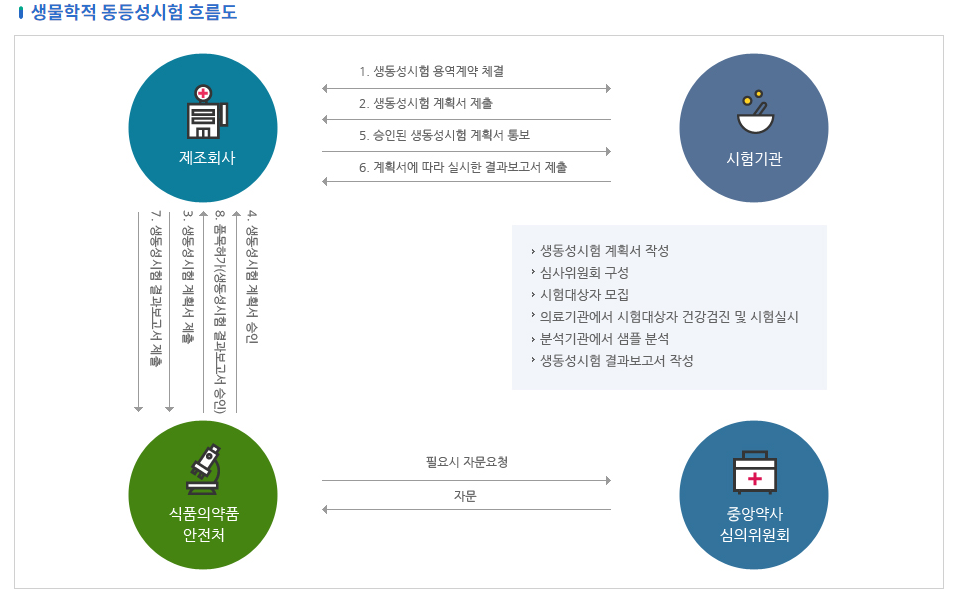
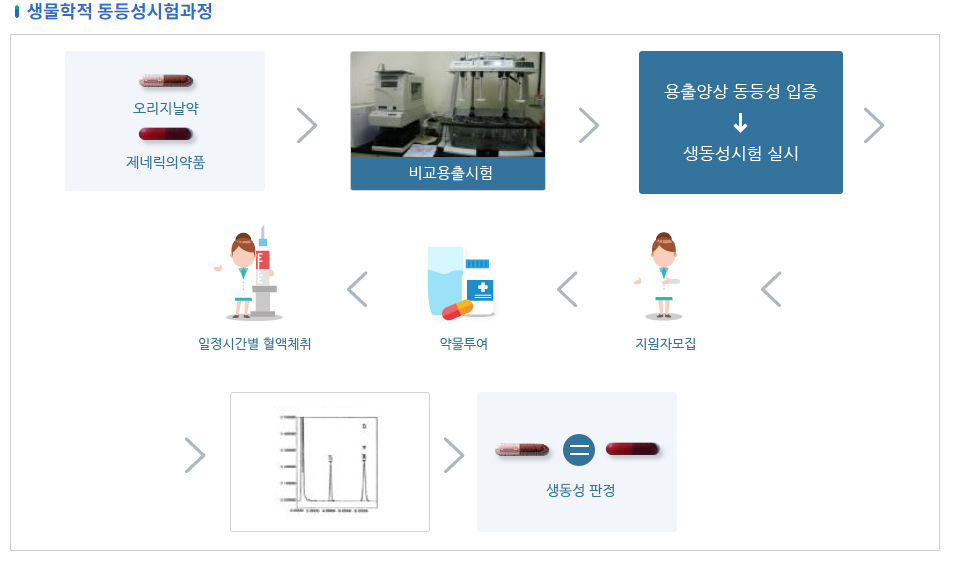
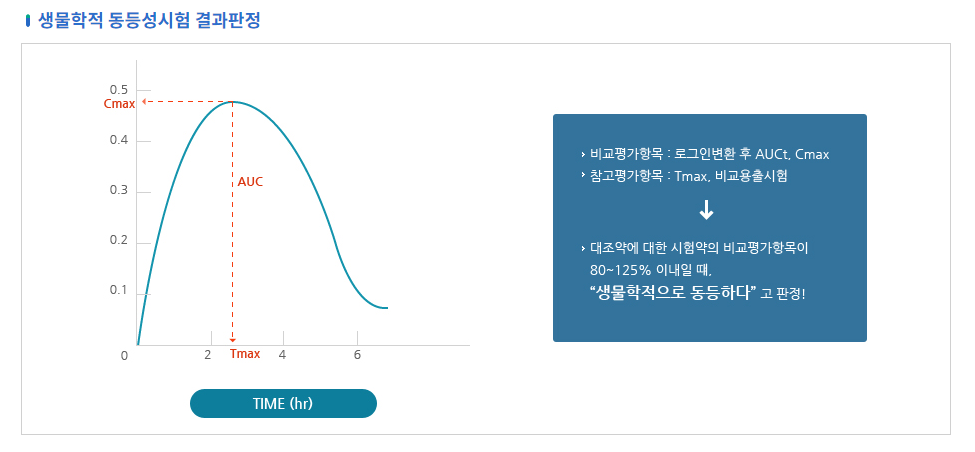
생동성 시험흐름도
- 생물학적 동등성시험 흐름도
- 생물학적 동등성시험과정
- 생물학적 동등성시험 결과
생동성 시험대상 품목
의약품 등의 안전에 관한 규칙(제4조제1항제3호)에 따른 품목허가 신청시 제출자료
의약품 등의 안전에 관한 규칙 제4조제1항제3호. 다음 각 목의 어느 하나에 해당하는 품목의 경우에는 생물학적 동등성시험에 관한 시험자료, 비교임상시험 성적서에 관한 자료. 다만, 식품의약품안전처장이 고시하는 품목의 경우에는 비교용출시험자료 등 생체를 이용하지 아니하는 시험자료로서 식품의약품안전처장이 고시하는 자료를 제출한다.
- 가. 1989년 1월 1일 이후 제조판매ㆍ수입 품목허가를 받은 전문의약품으로서 신약에 해당하는 의약품(제형이 다른 동일투여경로의 품목을 포함한다)
- 나. 가목에 해당하는 품목을 제외한 전문의약품으로서 이미 제조판매ㆍ수입 품목허가를 받은 것과 성분이 동일한 정제ㆍ캡슐제ㆍ좌제ㆍ산제(散劑)ㆍ과립제ㆍ점안제(點眼劑)ㆍ점이제(點耳劑)ㆍ폐에 적용하는 흡입제 또는 외용제제. 다만, 상용(常用) 의약품, 고가(高價) 의약품, 단일성분의 의약품 또는 의약품 동등성 확보가 필요한 의약품으로서 식품의약품안전처장이 고시하는 것이어야 한다.
- 다. 가목 또는 나목에 해당하는 품목을 제외한 전문의약품 중 이미 제조판매ㆍ수입 품목허가를 받은 품목과 그 성분이 동일한 전문의약품
의약품의 품목허가·신고·심사 규정에 따른 안전성, 유효성 심사자료로 제출
제25조(안전성·유효성 심사대상)
② 제1항단서에도 불구하고 다음 각 호의 어느 하나에 해당하는 의약품의 경우에는 제5조에서 정한 자료를 첨부하여 안전성ㆍ유효성에 대한 심사를 받아야 한다.
- 3. 다음 각 목의 어느 하나에 해당하는 품목의 경우
- 가. 「의약품 등의 안전에 관한 규칙」제4조제1항제3호가목에 해당하는 1989년 1월 1일 이후 제조(수입)품목 허가된 전문의약품으로 제2조제7호에서 정하고 있는 신약에 해당하는 의약품(제형이 다른 동일투여경로의 품목을 포함한다)인 경우
- 나. 「의약품 등의 안전에 관한 규칙」제4조제1항제3호나목에 해당하는 품목
- 다. 「의약품동등성시험기준」(식품의약품안전처 고시) 제3조제1항에 의해 생물학적동등성시험을 실시하여야 하는 경우
- 라. 「의약품 등의 안전에 관한 규칙」제4조제1항제3호다목에 해당하는 품목
- 4. 법 제33조, 「마약류관리에관한법률」 제57조 및 「의약품 재평가 실시에 관한 규정」(식품의약품안전처 고시) 제4조제2항에 따라 국내에서 실시한 임상시험성적에 관한 자료 등으로 의약품재평가를 실시하고 그 결과가 공시된 의약품과 동일한 의약품(제형이 다른 동일투여경로의 품목을 포함한다)인 경우
- 5. 이미 허가ㆍ신고된 품목과 용법ㆍ용량은 동일하나 제제기술의 변화로 인해 약물의 방출 또는 용출기전이 상이하여 체내 흡수량 또는 흡수속도의 변화를 확인할 필요가 있는 경우 등 제형의 특수성이 인정되는 제제(예 : 경피흡수제, 이식제, 서방형제제, 설하정, 정량용분무제제중 폐에 적용하는 흡입제, 현탁성 주사제 등)
제27조(안전성·유효성 심사자료 제출범위)
- ① 의약품의 안전성ㆍ유효성 심사를 위하여 제출하여야 하는 자료의 종류는 제5조제1항에서 정한 바와 같으며, 각 의약품의 특성에 따라 제출하여야 하는 자료의 범위는 별표 1의 의약품의 종류 및 제출자료의 범위와 같다.
- ③ 제25조제2항제3호에 해당하는 의약품의 경우에는 생물학적동등성시험자료 또는 비교임상시험성적에 관한 자료 및 별표 14의 1. 기허가의약품과 주성분의 규격 및 분량, 제형이 동일한 의약품에 해당하는 자료를 제출하여야 한다. 다만, 제1호부터 제6호 중 어느 하나에 해당하는 경우에는 이화학적동등성시험자료(제형을 고려한 물리화학적 특성(예: pH, 비중 또는 밀도, 삼투압, 점도 등)에 관한 자료)로, 제7호 또는 제8호에 해당하는 경우에는 「의약품동등성시험기준」(식품의약품안전처 고시)에 따른 비교용출시험자료로 갈음할 수 있다.
1.~8.(생략) - ④ 제25조제2항제4호에 따라 의약품재평가 결과가 공시된 제제로 이미 허가ㆍ신고된 의약품과 동일한 품목을 제조 또는 수입하고자 하는 경우 다음 각 호의 어느 하나의 자료를 첨부하여야 한다.
- 1. 생물학적동등성시험자료
- 2. 비교임상시험성적에 관한 자료(비교임상시험 자체가 이론적 ㆍ 기술적으로 실시 불가능할 경우 비비교(단독)임상시험 성적에 관한 자료)
- ⑤ 제25조제2항제5호에 따른 제형의 특수성이 인정되는 제제의 경우에는 다음 각 호의 자료를 첨부하여야 한다.
- 1. 생물학적동등성시험자료 또는 임상시험성적에 관한 자료. 다만, 폐에 적용하는 흡입제로서 대조약과 시험약의 약제학적 투여형태, 흡입기구를 통해 흡입되는 양, 흡입기구의 취급방법, 흡입기구의 기류에 대한 동일한 저항성, 목표전달량 등 비교 시험을 통해 약물이 폐에 도달하는 정도가 유사함을 입증한 경우에는 이화학적동등성 시험자료로 갈음하여 제출할 수 있다.
- 2. 안정성에 관한 자료
의약품동등성시험기준
기허가 품목의 원료약품 분량의 변경수준에 따라 일정 수준이상의 변경인 경우
대체조제용 의약품
약사법 제27조제2항제1호
728x90
반응형
'사이트,정보' 카테고리의 다른 글
| 임상시험참여 (0) | 2024.08.31 |
|---|---|
| 임상시험에 대해 알아보자 (5) | 2024.08.31 |
| 제네릭 의약품 개발 및 제네릭의약품 관련용어 (1) | 2024.08.31 |
| 의약품 개발 및 허가과정에 대해 알아보자. (1) | 2024.08.30 |
| 회사 직급 정리, 연구 직급, 각종 회사 직책 직급 한번에 정리,생산직/기능직 직급에 대해 알아보자. (1) | 2023.04.04 |




댓글